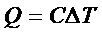Senin, 16 Mei 2016
Petunjuk Penggunaan
Petunjuk Penggunaan Blog :
Langkah-langkah yang perlu kamu ketahui dan kamu ikuti untuk belajar dengan blog ini yaitu :
- Baca petunjuk penggunaan terlebih dahulu
- Blog ini hanya diperuntukkan oleh guru dan siswa
- Diskusi belajar dapat dilakukan pada pikul 07.00-14.00 WIB
- Jika ada yang belum jelas bisa langsung didiskusikan secara kelompok dalam chat box dan juga chatwee yang sudah disediakan atau juga bisa ditanyakan secara pribadi kepada guru melalui kotak pesan yang sudah tersedia
- Jika siswa menemukan fenomena alam yang berkaitan dengan materi dapat dibagikan langsung di grup chat atau dikirim ke alamat email yunii.yuniiatii@gmail.com agar dapat dibagikan dengan teman yang lain dan didiskusikan bersama
Petunjuk Belajar Siswa :
- Keberhasilan belajar dengan media blog tergantung dari kedisiplinan dan ketekunan dalam memahami dan mematuhi langkah-langkah belajarnya
- Belajar dengan media blog ini dapat dilakukan secara mandiri atau kelompok baik di sekolah maupun di luar sekolah
- Materi dalam blog ini telah dirancang serinci mungkin, kamu boleh mencari tambahan pengetahuan dari sumber-sumber lain
- Blog ini berisi materi tentang Hukum I Termodinamika dan Hukum II Termodinamika
- Langkah-langkah yang perlu kamu ketahui dan kamu ikuti untuk belajar dengan blog ini yaitu :
a. Baca dan pahami SK, KD, dan tujuan pembelajaran yang terdapat dalam blog ini
b. Perhatikan dan pahami peta konsep yang tersedia
c. Perhatikan dan pelajari uraian materi dan contoh soal yang terdapat dalam blog
d. Bila semua materi sudah diselesaikan dengan baik, kamu berhak mengikuti uji kemampuan atau latihan soal yang sudah disediakan di blog ini
e. Bila nilai latihan soal dapat mencapai ≥ 75 % maka kamu sudah dianggap menguasai materi ini. Namun jika nilai belum mencapai ≥ 75 %, maka kamu harus mengulang aktivitas belajar, terutama pada bagian yang belum kamu pahami
f. Urutan kegiatan ini harap diikuti tujuannya tidak lain agar kamu lebih cepat berhasil mempelajari blog ini
Sabtu, 14 Mei 2016
Contoh Hukum II Termodinamika
Diketahui 10 gram air bersuhu 27 oC dihubungkan dengan reservoir yang mempunyai suhu 77 oC. Jika suhu air mencapai 77 oC, maka tentukan perubahan entropi dari air, reservoir, dan keseluruhan sistem...
Contoh Siklus Carnot
Soal no 1
Sebuah mesin Carnot bekerja di antara dua reservoir panas 487 oC dan reservoir dingin 107 oC. Jika mesin tersebut menyerap kalor 800 J dari reservoir panas, maka jumlah kalor yang dibuang dari mesin adalah...
Soal no 2
Sebuah mesin Carnot yang menggunakan reservoir suhu tinggi 600 K mempunyai efisiensi 20 %. Agar efisiensinya maksimum naik menjadi 60 %, suhu reservoir rendah tetap, maka seharusnya suhu reservoir suhu tinggi adalah ...
Soal no 3
Soal no 3
Suatu mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi 40 %. Jika reservoir panasnya bersuhu 640 K, maka efisiensinya adalah....
Soal no 4
Soal no 4
Suatu pesawat pendingin Carnot mempunyai koefisien kinerja 6,5. Jika reservoir yang tinggi 27 oC, maka reservoir yang bersuhu rendah adalah...
Contoh Kapasitas Kalor
Suatu gas massanya 7 gram dan massa molekulnya 28 gram/mol dipanaskan dari 280 K pada proses isobarik membutuhkan 2900 J. Hitunglah :
a. Kapasitas kalor pada tekanan tetap dan kapasitas kalor pada volume tetap
b. Kalor yang diperlukan untuk memanaskan gas dari 280 K menjadi 330 K pada volume tetap
a. Kapasitas kalor pada tekanan tetap dan kapasitas kalor pada volume tetap
b. Kalor yang diperlukan untuk memanaskan gas dari 280 K menjadi 330 K pada volume tetap
Kamis, 12 Mei 2016
Contoh Soal Hukum I Termodinamika
Hukum I Termodinamika
Soal no 2
1,5 gas helium yang bersuhu 27 oC dipanaskan secara isobarik 87 oC. Jika tekanan gas helium 2 ×102 N/m2, gas helium melakukan usaha luar sebesar...
Soal no 4
Perhatikan gambar berikut :
Suatu gas mengalami proses A-B-C. Usaha yang dilakukan gas pada proses di samping adalah ...
Soal no 1
Suatu gas memiliki volume awal 2,0 m3 dipanaskan dengan kondisi hingga volume akhirnya menjadi 4,5 m3. Jika tekanan gas adalah 2 atm tentukan usaha luar gas tersebut! (1 atm = 1,01 × 105 Pa)
Soal no 2
1,5 gas helium yang bersuhu 27 oC dipanaskan secara isobarik 87 oC. Jika tekanan gas helium 2 ×102 N/m2, gas helium melakukan usaha luar sebesar...
Soal no 3
2000/693 mol gas helium pada suhu tetap 27 oC mengalami perubahan volume dari 2,5 L menjadi 5 L. JIka R = 8,314 J/mol K dan ln 2 = 0,693 tentukan usaha yang dilakukan gas helium!
Soal no 4
Perhatikan gambar berikut :
Suatu gas mengalami proses A-B-C. Usaha yang dilakukan gas pada proses di samping adalah ...
Hukum II Termodinamika
Ada beberapa pernyataan
tentang hukum II Termodinamika, diantaranya :
Keterangan :
K = koefisien daya guna
Q1 = kalor pada reservoir suhu tinggi (J)
Q2 = kalor pada reservoir suhu rendah (J)
T1 = suhu pada reservoir tinggi (K)
T2 = suhu pada reservoir tinggi (K)
(18)
Ciri proses reversible adalah perubahan total entropi (ΔS = 0) baik bagi sistem maupun lingkungannya. Pada proses irreversibel perubahan entropi ΔSsemesta > 0. proses irreversible selalu menaikkan entropi semesta. (19)
Keterangan :
(ΔS)H = perubahan entropi lingkungan
- Pernyataan Clausius (tentang kalor)
Kalor
mengalir secara alami dari benda yang panas ke benda yang dingin; kalor tidak
akan mengalir secara spontan dari benda dingin ke benda panas. Pernyataan
Clasius sehubungan dengan prinsip kerja Refrigator (mesin pendingin).
Bagan
skema energi mesin pendingin yaitu sebagai berikut :
Secara matematis dapat dirumuskan sebagai berikut :
(17)
Keterangan :
K = koefisien daya guna
Q1 = kalor pada reservoir suhu tinggi (J)
Q2 = kalor pada reservoir suhu rendah (J)
T1 = suhu pada reservoir tinggi (K)
T2 = suhu pada reservoir tinggi (K)
- Pernyataan Kelvin-Planck (tentang mesin kalor)
- Pernyataan umum (tentang entropi)
(18)
Ciri proses reversible adalah perubahan total entropi (ΔS = 0) baik bagi sistem maupun lingkungannya. Pada proses irreversibel perubahan entropi ΔSsemesta > 0. proses irreversible selalu menaikkan entropi semesta. (19)
Keterangan :
(ΔS)H = perubahan entropi lingkungan
(ΔS)C = perubahan entropi sistem
Rabu, 11 Mei 2016
Siklus Carnot
Siklus carnot adalah gabungan proses-proses yang akan kembali ke keadaan semula. Siklus Carnot terdiri atas empat proses yaitu 2 proses adiabatik dan 2 proses isotermik. Berikut ini adalah gambar dari siklus carnot :
 |
| Siklus Carnot |
AB dan CD adalah proses isotermik. Sedangkan BC dan DA adalah proses adiabatik. Pada proses AB proses menyerap kalor Q1 dan saat proses CD melepas kalor sisa Q2. Selama siklus terjadi dapat menghasilkan usaha. Dan berlaku hubungan seperti persamaan berikut :
(13)Berikut ini adalah animasi tentang siklus carnot :
Dari siklus Carnot diatas untuk kemudian dapat dibuat suatu mesin yang dapat memanfaatkan suatu aliran kalor secara spontan sehingga dinamakan mesin kalor. Perhatikan gambar mesin kalor berikut :
 |
| Skema Mesin Kalor |
Mesin kalor menyerap kalor dari reservoir bersuhu tinggi T1
sebesar Q1
. Mesin menghasilkan kerja sebesar W dan membuang sisa kalornya ke reservoir bersuhu rendah T1
sebesar Q1
. Dari penjelasan tersebut terlihat bahwa tidak ada sebuah mesin yang memanfaatkan semua kalor yang diserap Q1
untuk melakukan kerja W. Pasti selalu ada yang terbuang. Artinya setiap mesin kalor selalu memiliki efisiensi. Efisiensi mesin kalor ini didefinisikan sebagai berikut :
(14)
Jika disubstitusikan nilai W dapat diperoleh persamaan berikut :
(15)
Untuk siklus carnot berlaku hubungan Q2/Q1 = T2/T1, sehingga efisiensi mesin carnot dapat dinyatakan sebagai berikut :
(16)
Keterangan :
η = efisiensi mesin carnot
T1 = suhu reservoir bersuhu tinggi (K)
T2 = suhu reservoir bersuhu rendah (K)
Kapasitas Kalor
Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu sebesar 1 kelvin.
Secara matematis dapat dinyatakan dengan persamaan berikut :
(5)
Keterangan :
Q = kalor yang diserap (J)
C = kapasitas kalor (J/K)
ΔT = perubahan suhu (K)
Persamaan ini berlaku untuk gas. Kalor yang diberikan kepada gas untuk menaikkan suhunya dapat dilakukan pada tekanan tetap (proses isobarik) atau pada volume tetap (proses isokorik). Oleh karena itu, pada gas ada dua jenis kapasitas kalor, yaitu kapasitas kalor pada tekanan tetap (Cp) dan kapasitas kalor pada volume tetap (Cv).
Secar matematis dapat ditulis seperti berikut :
(6)
Keterangan :
Qv = kalor yang diberikan pada volume tetap
Qp = kalor yang diberikan pada tekanan tetap
Hukum I termodinamika pada proses isobaris Qp = ΔU + W , sedangkan untuk proses isobarik Qv = ΔU. Bila kedua persamaan digabungkan, diperoleh :
(7)
Berdasarkan persamaan gas ideal pV = nRT, maka pΔV/ΔT = nR. Oleh karena itu persamaan di atas dapat ditulis sebagai berikut :
(8)
1. Untuk Gas Monoatomik
(9)
2. Gas Diatomik
(10)
Pada suhu Sedang (160 K < T < 5000 K)
(11)
Pada suhu tinggi (T > 5000 K)
(12)
Secara matematis dapat dinyatakan dengan persamaan berikut :
(5)
Keterangan :
Q = kalor yang diserap (J)
C = kapasitas kalor (J/K)
ΔT = perubahan suhu (K)
Persamaan ini berlaku untuk gas. Kalor yang diberikan kepada gas untuk menaikkan suhunya dapat dilakukan pada tekanan tetap (proses isobarik) atau pada volume tetap (proses isokorik). Oleh karena itu, pada gas ada dua jenis kapasitas kalor, yaitu kapasitas kalor pada tekanan tetap (Cp) dan kapasitas kalor pada volume tetap (Cv).
Secar matematis dapat ditulis seperti berikut :
(6)
Keterangan :
Qv = kalor yang diberikan pada volume tetap
Qp = kalor yang diberikan pada tekanan tetap
Hukum I termodinamika pada proses isobaris Qp = ΔU + W , sedangkan untuk proses isobarik Qv = ΔU. Bila kedua persamaan digabungkan, diperoleh :
(7)
Berdasarkan persamaan gas ideal pV = nRT, maka pΔV/ΔT = nR. Oleh karena itu persamaan di atas dapat ditulis sebagai berikut :
(8)
1. Untuk Gas Monoatomik
(9)
2. Gas Diatomik
(10)
Pada suhu Sedang (160 K < T < 5000 K)
(11)
Pada suhu tinggi (T > 5000 K)
(12)
Langganan:
Komentar (Atom)