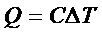Secara matematis dapat dinyatakan dengan persamaan berikut :
(5)
Keterangan :
Q = kalor yang diserap (J)
C = kapasitas kalor (J/K)
ΔT = perubahan suhu (K)
Persamaan ini berlaku untuk gas. Kalor yang diberikan kepada gas untuk menaikkan suhunya dapat dilakukan pada tekanan tetap (proses isobarik) atau pada volume tetap (proses isokorik). Oleh karena itu, pada gas ada dua jenis kapasitas kalor, yaitu kapasitas kalor pada tekanan tetap (Cp) dan kapasitas kalor pada volume tetap (Cv).
Secar matematis dapat ditulis seperti berikut :
(6)
Keterangan :
Qv = kalor yang diberikan pada volume tetap
Qp = kalor yang diberikan pada tekanan tetap
Hukum I termodinamika pada proses isobaris Qp = ΔU + W , sedangkan untuk proses isobarik Qv = ΔU. Bila kedua persamaan digabungkan, diperoleh :
(7)
Berdasarkan persamaan gas ideal pV = nRT, maka pΔV/ΔT = nR. Oleh karena itu persamaan di atas dapat ditulis sebagai berikut :
(8)
1. Untuk Gas Monoatomik
(9)
2. Gas Diatomik
(10)
Pada suhu Sedang (160 K < T < 5000 K)
(11)
Pada suhu tinggi (T > 5000 K)
(12)